国家药监局助力创新药“中国首发”
连涨三日后,创新药赛道又传来大消息。
国家药监局将助力创新药“中国首发”
1月6日至7日,全国药品监督管理工作会议在京召开。国家药监局局长李利表示,2026年国家药监局将精准施策,重点推进多项工作。
其中,药品领域将推动药品试验数据保护制度落地,研究建立儿童药品、罕见病用药市场独占期制度;对新机制、新靶点创新药,在沟通交流、临床试验、注册申报、审评审批全链条强化服务支持,助力创新药“中国首发”。
与此同时,国家药监局昨日发布公告称,为加快临床急需境外已上市药品在境内上市,满足患者临床用药迫切需求,决定进一步优化临床急需境外已上市药品审评审批工作机制。
公告显示,国家药监局鼓励申请人在中国开展全球同步研发、同步申报上市;鼓励临床急需境外已上市的原研药及仿制药在境内申报,对于符合要求的可纳入优先审评审批范围。
同时,国家药监局将优化审评机制,加快审评速度,并完善检验制度,体现品种特点。
对于临床急需境外已上市境内未上市的罕见病药品,鼓励申请人采取前置检验方式申请注册检验。只进行样品检验的,注册检验时限由60日缩短至40日;同时进行标准复核和样品检验的,注册检验时限由90日缩短至70日。

创新药产业链景气度有望持续提升
2025年,我国药品、医疗器械领域临床急需产品上市实现跨越式增长。国家药监局全年批准药品上市注册申请4087件,其中创新药76个,创历史新高。
数据显示,中国创新药商务拓展(BD)出海授权2025年交易总金额达1356.55亿美元,交易总数量达157笔,远超2024年全年的519亿美元和94笔。
展望未来,多家机构均表示,看好创新药产业链发展前景。
浙商证券指出,创新药概念具备显著估值修复潜力,主要基于三大逻辑:技术迭代驱动高景气赛道价值重估;全球化布局进入“兑现期”,商务拓展(BD)质量持续提升;政策构建“全链条支持”体系,支付端改革打开行业增长天花板。
“中国创新药产业已迈入2.0时代,发展路径从引进模仿转向创新输出。”中金公司认为,在国内工程师红利、丰富临床资源及支持性政策共同推动下,license out等国际化模式不断验证中国医药创新能力。这一转型不仅惠及创新药企,也带动CXO及产业链上游企业迎来新一轮成长周期。
在太平洋证券看来,医药行业已进入创新兑现与全球布局的关键阶段,投资机会将集中于具备全球竞争力的创新型企业。
该机构表示,医药生物行业在2026年将迎来产业周期、政策周期与资本周期的共振,中国创新药有望实现业绩拐点与估值重塑,重点关注以ADC、双/多特异性抗体、细胞与基因治疗、小核酸等为代表的下一代创新疗法。
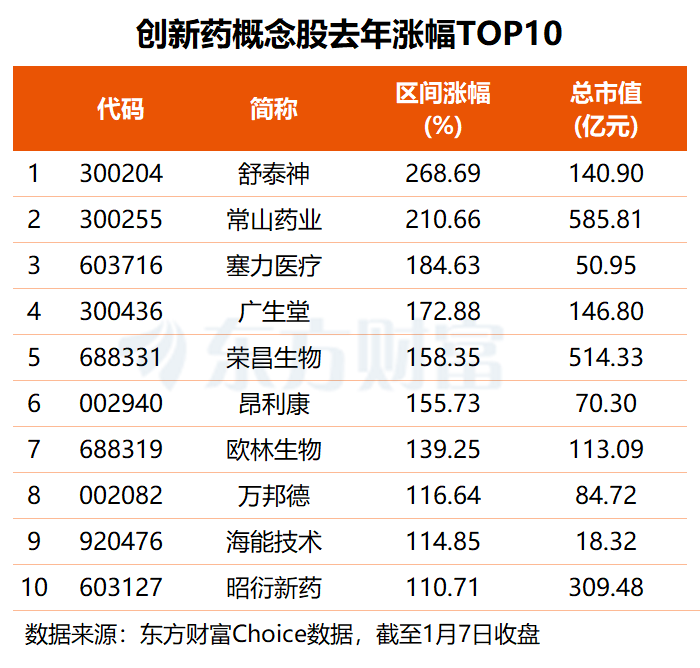
15只概念股去年股价翻倍
东方财富概念板块显示,目前A股市场共158股涉及创新药概念,合计总市值约3.67万亿元,百济神州、恒瑞医药体量居前...
声明:
- 风险提示:以上内容仅来自互联网,文中内容或观点仅作为原作者或者原网站的观点,不代表本站的任何立场,不构成与本站相关的任何投资建议。在作出任何投资决定前,投资者应根据自身情况考虑投资产品相关的风险因素,并于需要时咨询专业投资顾问意见。本站竭力但不能证实上述内容的真实性、准确性和原创性,对此本站不做任何保证和承诺。
- 本站认真尊重知识产权及您的合法权益,如发现本站内容或相关标识侵犯了您的权益,请您与我们联系删除。










推荐文章: